آنتی بادیها و قطعات کوچکترآنها
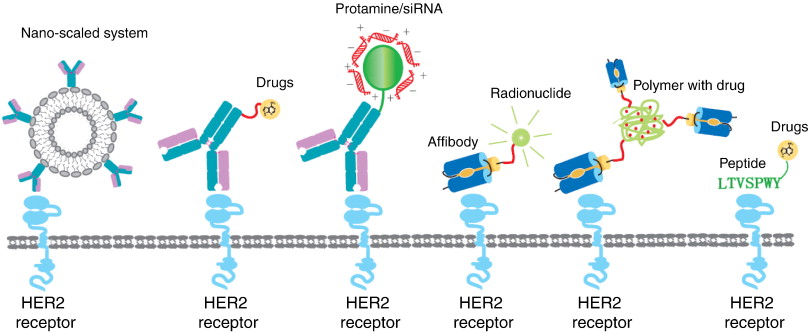
یکی ازگسترده ترین سیستمهای انتقال دهنده دارو به این گیرنده، آنتی بادیهای متصل شونده به ترکیبات نانو و ایمینولیپوزومها میباشند. برای تشخیص سرطانهایی که این گیرنده در سطح آن ها بیان میشود، از سیستمهای نانویی که سطح آنها با آنتی بادیهای ضد این گیرنده و مشتقات آنها (Fab یا ScFv) پوشانده شدند استفاده کردند. سیستمهای نانو نیز میتوانند برای انتقال داروهای مولکولی کوچک همانند داروهای اسید نوکلئیک استفاده شوند. انتقال هدفمند نوکلئیک اسیدها به سلولهای توموری دارای بیان بالا این گیرنده از طریق اتصال مشتقات Fab به کمپلکس لیپوزوم/DNA بررسی شده است.
تراستوزومب اگرچه به عنوان یک عامل هدفمند موفق در درمان سرطان استفاده میشود، اما ثابت شده است کارایی درمانی آن به صورت یک عامل تنها، محدود است. تراستوزومب تنها زمانی سودمند میباشد که سطح بیان گیرنده HER2 در بیماران +۳ باشد. به این منظور، اتصال داروهای شیمیایی با این آنتی بادی پیشرفت داده شد برای برطرف کردن این مشکل سودمند است. برای مثال یک آنالوگ جدید ویتامین د با عنوان D5 به عنوان عامل کاهنده رشد و متاستازی سلولهای توموری متفاوت هم در شرایط درون بدن و هم خارج بدن مطرح شد. اتصال این ویتامین با تراستوزومب اثر بازداری رشد سلولهای دارای بیان گیرنده HER2 را در شرایط درون بدن تقویت کرد. در ضمن، محدودیتهایی برای این روش وجود دارد که از آن جمله میتوان به موارد زیر اشاره کرد: محدودیت ساختن دوباره این اتصالات شیمیایی به خاطر این حقیقت که انواع محلهای مختلف برای اتصال در یک مولکول آنتی بادی واحد وجود دارد، آنتی بادیهای اصلاح شده از نظر شیمیایی تمایل بیشتری به تجمع نشان دادند مخصوصا زمانی که از چند دارو برای اتصال به آنتی بادی استفاده شود.
اتصال پروتئینها به آنتی بادیها از دیگر روشهای اصلاح میباشد که امتیاز آن نسبت به اتصال داروهای شیمیایی این است که پروتئین ضد تومور و لیگاند مورد هدف بطور مستقیم به صورت یک ترکیب واحد سنتز میشوند که از مراحل مختلف سنتز ترکیبات شیمیایی اجتناب میکند. یانگ و همکارانش یک ترکیب ScFv ضد این گیرنده با گرانزیم B سنتز کردند که به عنوان یک پروتئاز سرین گرانولی و توسط سلولهای کشنده طبیعی و لمفوسیتهای T تولید شده اند. همچنین اتصال آنتی بادی و یا مشتقاتش به پروتئین دارای بار مثبت مثل پروتامین و هیستیدین به منظور تشکیل کمپلکس با بار منفی اسیدهای نوکلئیک نیز در سال های اخیر مورد بررسی قرار گرفته است.
افی بادی ها
مولکول های افی بادی کوچک، پایدار، دارای دومین z 58 آمینو اسیدی مشتق شده از دومین اتصالی IgG به پروتئین A هستند. قسمت اتصال یک افی بادی از ۱۳ آمینواسید تشکیل شده است که می تواند بطور تصادفی به هدفهای متفاوت متصل شود. در مقابل آنتی بادی مونوکلونال، افی بادیها دارای امتیازاتی هستند. اول از همه بخاطر اندازه کوچک آن ها که توانایی نفوذ آنها را به سلول ضمانت می کند. دوم اینکه گروههای انتهایی قابل اتصال به گروههای شیمیایی به اندازه کافی از محل اتصال به گیرنده دور هستند. این امتیازات، افی بادیها را به عنوان یک وسیله ارزشمند برای انتقال داروها و تصویربرداری تومور مطرح می کند.
ویکمن و همکارانش برای اولین بار یک افی بادی ( His6-ZHER2-neu:4) را که بطور اختصاصی به دومین خارجی HER2 متصل میشود با یک افینیتی ۵۰ نانو مولار شناسایی کردند. از آن پس مطالعات گستردهای درباره افی بادیهای ضد این گیرنده به عنوان ابزار تصویربرداری بعد از اتصال به یک رادیوایزوتوپ، انجام شد. آنتی بادیهای قدیمی که به مولکول های تصویربرداری متصل می شدند، زمان توزیع بیولوژیکی طولانی، توانایی ضعیف در نفوذ به سلولها و کلیرانس خونی پایین داشتند. همچنین عاملهای تصویربرداری بهبودیافته همانند ScFv به اندازه کافی کوچک نبودند تا توزیع، نفوذ و کلیرانس خونی را سرعت ببخشند. در مقابل، افینیتی بالا و اندازه کوچک افی بادیهای ضد این گیرنده در کلیرانس سریع از پلاسما و نسبت بالای تومور به زمینه مطلوب بودند. اورلووا و همکارانش شلاتور تترا آزاسیکلودودکان تترا استیک اسید (DOTA) را با ایندیوم-۱۱۱ نشاندار سازی کردند و سپس به افی بادی ضد HER2 با عنوان ZHER2:342-pep2 متصل کردند. این ترکیب برای تومورهایی با HER2 مثبت اختصاصی بود و نسبت بالای تومور به خون ( ۷٫۵) را به خوبی نشان داد که باعث ایجاد یک تصویر با وضوح بالا بعد از یک ساعت از زمان تزریق شد. درمان با تراستوزومب، با تصویربرداری تومور مداخله نکرد در حالیکه تخریب گیرنده HER2، تصویربرداری تومور را مبهم کرد. همچنین اتصال دو افی بادی شناخته شده نیز می تواند تمایل به اتصال را افزایش دهد.
بخاطر چرخش پلاسمایی کوتاه و کلیرانس سریع خونی، افی بادیها برای تصویربرداری تومور مناسب هستند ولی برای اتصال به داروها و رادیودرمانی مناسب نیستند. بنابراین، افزایش زمان زنده ماندن افی بادیها برای درمان هدفمند نیاز است. تکنولوژی اتصال به آلبومین، نیمه عمر پلاسمایی افی بادی را افزایش داده است. اتصال افی بادی به دومین اتصال آلبومین (ABD)، افزایش نیمه عمر افی بادی را در موش نشان داده است. کارترن و انگفلت با شلاتورهایی با پایه پپتید در انتهای N مولکولهای سنتزی افی بادی که با تکنسیم-۹۹m نشاندار شده بود، نشان دادند که فقط تغییرات کوچک در پلی پپتیدها میتواند منجر به تغییرات قابل توجه توزیع بیولوژیکی مولکولهای افی بادی شود. بوسیله جایگزینی تنها سه اسید آمینه هیدروفوب در ساختار شلاتورهای بر پایه پپتید، مسیر دفعی از سیستم کبدی به سیستم کلیوی هدایت شد و پایداری کی لیت تکنسیم-۹۹m نیز افزایش پیدا کرد.

پپتیدها
در مقایسه با آنتی بادیها، ScFv ها و افی بادیها، پپتیدها به عنوان عاملهای هدفمند مناسب تری مشخص شدند که به دلیل وزن مولکولی پایین آنها، نفوذ عالی آنها به بافت یا سلول، سهولت سنتز و انعطاف پذیری در اتصالات شیمیایی بود. تلاشهای زیادی برای سنتز پپتیدهایی که افینیتی به گیرنده HER2 دارند، انجام شده است. مورالی و همکارانشان یک پپتید ضد این گیرنده با وزن ۵/۱کیلو دالتون (AHNP) طراحی کردند که بطور اختصاصی به گیرنده HER2 متصل می شود با قدرت مشابه با تمام طول آنتی بادی تراستوزومب. از آن پس، این پپتید به عنوان یک عامل هدفمند به منظور انتقال اختصاصی عوامل درمانی به سلول های سرطانی HER2 مثبت استفاده شد. برای مثال پپتید نفوذ کننده به سلول (CPP) در عبور از غشای سلولی و انتقال انواع مختلف ترکیبات به داخل سلول بسیار کاربردی است ولی در اختصاصی بودن محدودیت دارد و از اینرو نمیتوان از آن در کارهای درمانی استفاده کرد. بوسیله اتصال CPP به AHNP، یک عامل انتقال دهنده جدید به منظور مورد هدف قرار دادن سلول های HER2 مثبت هم در شرایط خارج بدن و هم داخل بدن ایجاد شد. همچنین پپتید AHNP به طور مستقیم به یک پپتید ایجادکننده آپوپتوز از طریق سمیت در میتوکندری (PAP) متصل شد و به صورت یک پپتید دوعاملی برای مورد هدف قرار دادن سلولهای توموری HER2 مثبت استفاده شد که مانع از رشد این سلولهای توموری میشود.
اخیرا روش سیلیکو برای طراحی پپتیدهای ضد گیرنده HER2 بطور مستقیم از طریق آنالیز ساختار سه بعدی کمپلکس آنتی بادی-HER2 بکاررفته است. یک پپتید کوچک HRAP با استفاده از روش طراحی دارو براساس ساختار به کمک کامپیوتر شناسایی شد. این پپتید از رشد این سلولهای سرطانی بدون القای آپوپتوز بازداری میکند. این پپتید می تواند به عنوان یکی دیگر از انتقال دهنده های هدفمند دارو به سلول های توموری HER2 مثبت باشد.
نویسنده مقاله: خانم دکتر حمیده صباح نو متخصص داروسازی هسته ای
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی