تحلیل سوال ۹۹ کنکور تجربی ۱۴۰۲ نوبت دوم
دکتر مهدی نباتی – استاد شیمی کنکور و المپیاد
مدرس شیمی رتبه های تک رقمی و دو رقمی
شیمی کنکور استاد نباتی
تدریس خصوصی شیمی کنکور
سوال ۹۹ شیمی کنکور تجربی ۱۴۰۲ نوبت دوم، یک سوال سخت و نکته دار از مبحث اسیدهای قوی و ضعیف از فصل اول شیمی دوازدهم کنکور است.
برای حل این سوال بایستی شما عزیزانم به تمام نکات اسیدها و بازها و مبحث غلظت محلول ها، درجه یونش و ثابت تعادل واکنش های تعادلی تسلط کافی داشته باشید.
خب حالا بریم سراغ تحلیل سوال…
شیمی کنکور استاد نباتی
سوال ۹۹ کنکور تجربی ۱۴۰۲ نوبت دوم
با توجه به شکل زیر که فرایند یونش محلول دو اسید HA و HX (با حجم، دما و غلظت یکسان) را نشان می دهد. کدام موارد زیر درست است؟
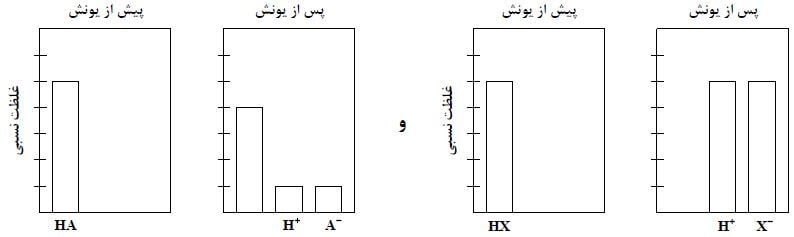
الف: pH محلول اسید HA کوچکتر از pH محلول اسید HX است.
ب: [+H] در محلول اسید HX چهار برابر [+H] در محلول اسید HA است.
پ: اگر غلظت مولار آغازین HA برابر ۰٫۸ باشد، ثابت یونش آن برابر ۰٫۰۴ است.
ت: اگر A و X دو عنصر از گروه ۱۷ جدول تناوبی باشند، به یقین جرم مولی HX از جرم مولی HA بیشتر است.
شیمی کنکور استاد نباتی
۱: “الف” و “پ” ۲: “پ” و “ت” ۳: “الف” و “ب” ۴: “ب” و “ت”
شیمی کنکور استاد نباتی
پاسخ:
تحلیل مطلب الف:
اگر به شکل توجه کنیم می بینیم که اسید HA در محیط آبی به طور کامل یونیده نشده در حالی که اسید HX به طور کامل یونیده شده است. بنابراین HA اسید ضعیف و HX اسید قوی است. بنابراین pH اسید قوی HX باید کوچکتر باشد.
پس مطلب الف درست بیان نشده است.
تدریس شیمی کنکور استاد نباتی
تحلیل مطلب ب:
اگر به واحدهای غلظت در نمودارها توجه کنیم که پس از یونیده شدن، غلظت یون هیدرونیوم در اسید قوی HX پنج برابر اسید HA است.
پس مطلب ب درست بیان نشده است.
تدریس شیمی کنکور استاد نباتی
تحلیل مطلب پ:
اگر غلظت اولیه اسید HA برابر ۰٫۸ باشد پس هر واحد در این نمودار برابر ۰٫۱۶ مولار می باشد. بنابراین پس از یونش غلظت گونه های HA و +H و –A به ترتیب برابر ۰٫۶۴ و ۰٫۱۶ و ۰٫۱۶ مولار می باشد. بنابراین ثابت یونش برابر ۰٫۰۴ مولار می باشد.
K = [H+][A-] / [HA]
⇓
K = (0.16 × ۰٫۱۶) / ۰٫۶۴ = ۰٫۰۴ mol/L
پس مطلب پ درست بیان شده است.
تدریس شیمی کنکور استاد نباتی
تحلیل مطلب ت:
اگر X و A مربوط به گروه ۱۷ باشند، چون HA اسید ضعیفی است پس حتما اسید HF می باشد و از طرفی HX چون قوی است پس حتما HCl، HBr و یا HI می باشد.
در هر حالت جرم مولی اسید HX بیشتر از اسید HA است.
پس مطلب ت درست بیان شده است.
تدریس شیمی کنکور استاد نباتی
گزینه صحیح:
با توجه به تحلیل های انجام شده، گزینه ۲ پاسخ صحیح سوال ۹۹ کنکور تجربی نوبت دوم ۱۴۰۲ می باشد.
شیمی کنکور استاد نباتی
*** در فایل ویدیویی زیر، سوال ۹۹ کنکور تجربی نوبت دوم ۱۴۰۲ را به طور کامل برای شما عزیزان تحلیل کرده و توضیح داده ام.
پس حتما فایل آموزشی زیر را به دقت ببینید و نکات گفته شده برای تحلیل سوالات مبحث اسیدهای قوی و ضعیف را یاد بگیرید.
شیمی کنکور استاد نباتی
شیمی کنکور استاد نباتی
پاسخ سوالات کنکور تجربی ۱۴۰۲ نوبت دوم – تحلیل کامل سوال ۹۹
شیمی کنکور استاد نباتی
شیمی کنکور استاد نباتی
با آرزوی موفقیت برای شما دانش آموزان عزیزم
شیمی کنکور استاد نباتی
استاد شیمی کنکور و المپیاد ایران
شیمی کنکور استاد نباتی

تدریس خصوصی آنلاین شیمی کنکور و المپیاد شیمی تهران کرج شیراز بندرعباس ساری شهریار آستارا اردبیل لاهیجان بابل تبریز کرمان دزفول اهواز همدان خرم آباد بوشهر
تدریس خصوصی و تکنیکی شیمی کنکور تجربی و ریاضی
استاد خصوصی آنلاین المپیاد شیمی و شیمی کنکور کرمانشاه شهرکرد زاهدان زنجان آمل قائم شهر شاهین شهر سبزوار نیشابور نهاوند بندر انزلی سنندج ایلام مراغه گرگان
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی


