آموزش خصوصی شیمی کنکور و المپیاد با روش تحلیلی
سوال امتحانی شیمی دهم دبیرستان دخترانه نوآوران تهران
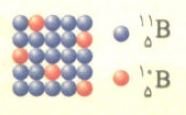
با توجه به شکل زیر که توزیع اتم های بور را در یک نمونه طبیعی از عنصر بور نشان می دهد، جرم اتمی میانگین بور را بر حسب amu به دست آورید.
پاسخ:
دانش آموزان عزیزم از روی شکل بالا می بینیم که در هر مجموعه ۲۵ تایی از اتم ها، تعداد ۵ اتم از نوع ایزوتوپ ۱۰B و تعداد ۲۰ اتم از نوع ایزوتوپ ۱۱B می باشد.
پس در اولین قدم باید درصد فراوانی هر کدام از این ایزوتوپ ها را در این نمونه طبیعی به دست آوریم. برای حصول این کار کافی است که تعداد هر کدام از ایزوتوپ ها را تقسیم بر تعداد کل اتم ها کرده و ضرب در ۱۰۰ بکنیم:
F10B = (5/25) × ۱۰۰ = ۲۰%
F11B = (20/25) × ۱۰۰ = ۸۰%
پس ۲۰ درصد از کل اتم ها از نوع ایزوتوپ ۱۰B و مابقی (۸۰ درصد) از نوع ایزوتوپ ۱۱B می باشد.
حالا می رسیم به محاسبه جرم اتمی میانگین بور:
M = F1M1 + F2M2
⇓
M = 0.2 × ۱۰ + ۰٫۸ × ۱۱ = ۱۰٫۸ amu
بنابراین جرم اتمی میانگین بور برابر با ۱۰٫۸ گرم بر مول می باشد.

تدریس خصوصی و گروهی شیمی دهم و یازدهم و دوازدهم در تهران
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی



