بررسی کنکوری واکنش های مهم شیمی با دکتر نباتی
تحلیل سینتیک واکنش الکتروشیمی استاد دکتر مهدی نباتی
دانش آموزان عزیزم، واکنش تیغه روی با محلول مس (II) سولفات یکی از واکنش های بسیار مهم است که در فصل دوم شیمی یازدهم آورده شده است ولی در حقیقت مبحث مشترک سینتیک شیمی یازدهم و الکتروشیمی شیمی دوازدهم می باشد.
شدیدا توصیه می کنم که این واکنش را خوب یاد بگیرید. چون در ادوار کنکور سراسری، چندین بار مورد طرح سوال واقع شده است.
بنابراین در این مقاله می خواهم که نگاه دقیقی به شیمی این واکنش مهم بیندازیم…
نکات کنکوری واکنش تیغه روی با محلول مس (II) سولفات
دانش آموزان عزیز به شکل زیر نگاه کنید:

در تصویر سمت چپ، تیغه روی و محلول مس (II) سولفات را می بینیم که با وارد کردن تیغه به درون محلول، محلول بی رنگ شده و در عوض به روی تیغه یک سری اتم های جدید رسوب کردند. اگر بخواهیم این فرایند را از دید شیمی دقیقتر نگاه کنیم به واکنش زیر می رسیم:
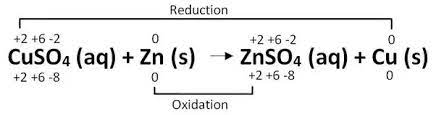
در حقیقت یک واکنش الکتروشیمیایی بین تیغه روی و محلول مس (II) سولفات اتفاق افتاده است.
توجه: اعدادی که در بالای هر اتم نوشته شده، عدد اکسایش هر اتم در آن گونه است. و اعدادی که در پایین نوشته شده، مجموع عدد اکسایش برای هر نوع اتم با تعداد موجود آن نوع اتم در گونه مربوطه است.
به وضوح می بینیم که دو نیم واکنش اتفاق افتاده است:
نیم واکنش اول که مس احیا شده است: یون +Cu2 دو الکترون گرفته و به اتم Cu احیا می شود.
نیم واکنش دوم که روی، اکسید شده است: اتم Zn دو الکترون از دست داده و به یون +Zn2 اکسید می شود.
نکته بسیار مهم: محلول CuSO4 آبی رنگ و محلول ZnSO4 بی رنگ می باشد.
خب حالا متوجه شدیم که:
در ابتدا فقط محلول آبی رنگ CuSO4 و تیغه Zn را داریم. ولی با گذشت زمان یون مس مصرف شده و احیا می شود و به صورت فلز سرخ رنگ مس بر روی تیغه نقره ای فلز روی انباشه می شود. و در مقابل، فلز روی اکسید شده و محلول بی رنگ روی سولفات تولید می شود.
نکته مهم: این واکنش تا جایی پیش می رود که مقدار واکنش دهنده ها (یون مس و فلز روی) کاهش می یابد تا تقریبا به صفر برسند و مقدار فراورده ها (فلز مس و یون روی) افزایش می یابد.
و اما برسیم به مهم ترین نکته کنکوری:
با گذشت زمان و با اتمام واکنش، جرم مواد جامد در این واکنش کاهش می یابد. چرا؟؟؟!!!
چون یون محلول مس با جرم سبک (جرم مولی ۶۴ گرم بر مول) به اتم مس تبدیل شده و جایگزین اتم سنگینتر از خودش یعنی اتم روی (جرم مولی ۶۵ گرم بر مول) می شود. و اتم روی هم به یون روی تبدیل می شود.
نکات رنگی این واکنش مهم
تیغه روی = نقره ای رنگ
فلز مس = سرخ رنگ
محلول مس (II) سولفات = آبی رنگ
محلول روی (II) سولفات = بی رنگ
نکته بسیار مهم یون سولفات
دانش آموزان عزیزم اگر به اعداد اکسایش اتم های سازنده یون سولفات در دو طرف واکنش دقت کنیم می بینیم که هیچ تغییری نکرده اند. پس یون سولفات در واکنش اکسایش کاهش شرکت نکرده است.

تدریس خصوصی و گروهی شیمی کنکور و المپیاد در تهران
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی



