بررسی نکات کنکوری و تحلیلی شیمی کنکور دکتر نباتی
آموزش حضوری و آنلاین شیمی کنکور استاد دکتر مهدی نباتی
دانش آموزان عزیزم، مبحث انحلال پذیری ترکیبات یونی در آب یکی از مهمترین مباحث شیمی دهم هست که حتما (چه به صورت مستقیم و چه به صورت یکی از گزینه های سوالات ترکیبی و چه در سوالات ترکیبی مسائل استوکیومتری یا مسائل اسید و بازها) در کنکور از آن سوال می آید. بنابراین واجب است که این مبحث را به طور کامل یاد بگیریم.
در این مقاله می خواهم فرمول های کنکوری و نکات تحلیلی دسته ای از ترکیبات یونی را برایتان آموزش دهم که نمودار انحلال پذیری آن ها به صورت خط راست می باشد.
فرمول ها و نکات کنکوری انحلال پذیری خطی
اگر تغییرات انحلال پذیری هر ترکیب یونی در آب با تغییرات دما به صورت خط راست باشد، نکات زیر را خواهیم داشت:
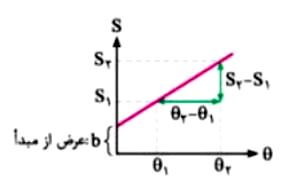
با استفاده از دانش ریاضیات می دانیم که برای به دست آوردن معادله خطوط راست، داشتن مختصات دو نقطه از آن کافی است.
در نمودار منحنی انحلال پذیری ترکیبات یونی، محور طول ها نشان دهنده تغییرات دمایی و محور عرض ها نشان دهنده تغییرات انحلال پذیری است.
انحلال پذیری هر ترکیب یونی یعنی مقداری از آن ماده که در دمای مشخص در ۱۰۰ گرم از آب قابل حل شدن است.
اگر:
دمای نقطه اول θ۱
دمای نقطه دوم θ۲
انحلال پذیری نقطه اول S1
انحلال پذیری نقطه دوم S2
باشد، به راحتی شیب نمودار (a) از نسبت تغییرات انحلال پذیری به تغییرات دمایی قابل حصول است:
a = ΔS / Δθ
ΔS نشان دهنده تغییرات انحلال پذیری در دو نقطه است:
ΔS = S2 – S1
Δθ نشان دهنده تغییرات دمایی در دو نقطه است:
Δθ = θ۲ – θ۱
نکته مهم: شیب نمودار نشان دهنده صعودی و یا نزولی بودن این تغییرات است:
- شیب مثبت a > 0 نشان دهنده صعودی بودن منحنی تغییرات انحلال پذیری است.
- شیب منفی a < 0 نشان دهنده نزولی بودن منحنی تغییرات انحلال پذیری است.
- شیب صفر a = 0 نشان دهنده عدم تغییرات انحلال پذیری با تغییرات دمایی است.
نکته بسیار مهم: هر چقدر قدر مطلق شیب نمودار بیشتر باشد، نشان دهنده بیشتر بودن تاثیر دما بر تغییرات انحلال پذیری آن ترکیب یونی است.
نکته مهم: انحلال پذیری ترکیب یونی در دمای صفر درجه سانتی گراد به نام عرض از مبدا (b) شناخته می شود.
فرمول کنکوری اول: اگر شیب و عرض از مبدا داده شود و انحلال پذیری در یک دمای مشخص خواسته شده باشد، از فرمول زیر استفاده خواهیم کرد:
S = aθ + b
فرمول کنکوری دوم: اگر شیب و مختصات یک نقطه (دما و انحلال پذیری در یک نقطه) داده شده باشد و انحلال پذیری در یک دمای مشخص خواسته شده باشد، از فرمول زیر استفاده خواهیم کرد:
S – S1 = a (θ – θ۱)
تست تالیفی شیمی دهم کنکور
با توجه به داده های زیر، چند گرم از پتاسیم کلرید در ۲۰۰ گرم آب در دمای ۷۰ درجه سانتی گراد می تواند حل شود؟
| ۶۰ | ۴۰ | ۲۰ | θ |
| ۴۶ | ۳۹ | ۳۳ | S |
الف: ۵۲
ب: ۴۸
ج: ۵۴
د: ۵۶
پاسخ:
دانش آموزان عزیزم، چون انحلال پذیری پتاسیم کلرید در دمای صفر درجه سانتی گراد (یعنی عرض از مبدا) داده نشده است، پس خیلی سریع به فرمول دوم فکر خواهیم کرد.
کافی است که ابتدا از طریق فرمول گفته شده در بالا، ابتدا شیب را به دست آوریم:
ΔS = S2 – S1 = 39 – 33 = 6
Δθ = θ۲ – θ۱ = ۴۰ – ۲۰ = ۲۰
a = ΔS / Δθ
⇓
a = 6 / 20 = 0.3
حالا می توانیم از فرمول کنکوری دوم، انحلال پذیری در دمای ۷۰ درجه سلسیوس را حساب کنیم:
S – S1 = a (θ – θ۱)
S1 = 33
θ۱ = ۲۰
a = 0.3
θ = ۷۰
⇓
S – 33 = 0.3 (70 – 20)
⇓
S = 48
گزینه صحیح:
با توجه به استفاده از فرمول های کنکوری و انجام محاسبات، مشاهده کردیم که گزینه ب جواب صحیح این تست تالیفی می باشد.

تدریس خصوصی و گروهی شیمی کنکور و المپیاد در تهران
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی


