تحلیل سوالات المپیاد شیمی آمریکا ۲۰۲۴
دکتر مهدی نباتی – استاد المپیاد شیمی ایران
تدریس المپیاد شیمی مرحله اول
تدریس المپیاد شیمی مرحله دوم
المپیاد شیمی آمریکا یکی از معتبرترین آزمون های دنیاست که هر ساله به طور منظم برگزار می شود. آزمون المپیاد ملی شیمی آمریکا در سال ۲۰۲۴ هم مثل سالهای اخیر در قالب ۶۰ سوال ۴ گزینه ای در مدت زمان ۱۱۰ دقیقه برگزار شد.
در این مقاله سوال ۲ آزمون المپیاد شیمی ۲۰۲۴ آمریکا را برای شما عزیزان با روش تستی حل می کنم تا با چنین تیپ سوالی و روش حل تکنیکی آن آشنا شوید.
جزوه المپیاد شیمی مرحله اول
جزوه المپیاد شیمی مرحله دوم
دانلود جزوه استوکیومتری المپیاد شیمی
دانلود جزوه المپیاد شیمی مرحله اول
دانلود جزوه المپیاد شیمی مرحله دوم
سوال ۲ المپیاد شیمی آمریکا ۲۰۲۴
Q2 – USNCO 2024
When 3.00 g of NH3 (g) (M = 17.03) reacts with 18.0 g of HCl (g) (M = 36.46), what is the theoretical yield of NH4Cl (s)?
A: 6.42 g
B: 8.41 g
C: 9.42 g
D: 21.0 g
دانلود جزوه استوکیومتری المپیاد شیمی مرحله اول
دانلود جزوه استوکیومتری المپیاد شیمی مرحله دوم
ترجمه سوال ۲ المپیاد شیمی آمریکا ۲۰۲۴
وقتی که ۳ گرم آمونیاک با جرم مولی ۱۷٫۰۳ گرم بر مول با ۱۸ گرم هیدروژن کلرید با جرم مولی ۳۶٫۴۶ گرم بر مول واکنش دهد، جرم تئوری آمونیوم کلرید جامد تولید شده چند گرم خواهد بود؟
الف: ۶٫۴۲ گرم
ب: ۸٫۴۱ گرم
ج: ۹٫۴۲ گرم
د: ۲۱٫۰ گرم
دانلود رایگان جزوه المپیاد شیمی مرحله اول
دانلود رایگان جزوه المپیاد شیمی مرحله دوم
دانلود جزوات طلایی المپیاد شیمی
دانلود رایگان جزوه استوکیومتری المپیاد شیمی مرحله اول
دانلود رایگان جزوه استوکیومتری المپیاد شیمی مرحله دوم
پاسخ سوال ۲ المپیاد شیمی آمریکا ۲۰۲۴
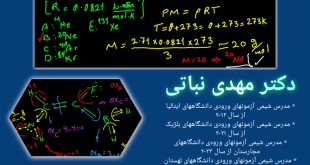
برای پاسخ به این سوال ابتدا بایستی واکنش آمونیاگ گازی با گاز هیدروژن کلرید را بنویسیم.
NH3 + HCl → NH4Cl
با توجه به اینکه برای هر دو واکنش دهنده، جرم داده شده است لذا بایستی مشخص کنیم که کدام یک از این دو واکنش دهنده محدودکننده می باشد:
nNH3 = m / M = 3 / 17.03 = 0.176 mol
nHCl = m / M = 18 / 36.46 = 0.494 mol
با توجه به اینکه تعداد مول گاز آمونیاک کمتر شد، لذا در این واکنش گاز آمونیاک واکنش دهنده محدودکننده می باشد.
حالا کافی است اطلاعات آمونیاک و آمونیوم کلرید را به صورت زیر مرتب کرده و با یک طرفین وسطین ساده، جرم آمونیوم کلرید جامد تولیدی را حساب کنیم.
| جرم مولی
۵۳٫۴۹ g/mol |
جرم مولی
۱۷٫۰۳ g/mol |
| NH4Cl | NH3 |
| جرم
x g |
جرم
۳ g |
حالا کافی است با یک طرفین وسطین کردن، جرم آمونیوم کلرید تولید شده در این واکنش را به دست آوریم.
x × ۱۷٫۰۳ = ۵۳٫۴۹ × ۳
x = 9.423 g
بنابراین ۹٫۴۲۳ گرم آمونیوم کلرید در این واکنش تولید می شود. لذا گزینه سوم پاسخ صحیح این سوال می باشد.
تدریس خصوصی المپیاد شیمی مرحله اول
تدریس خصوصی المپیاد شیمی مرحله دوم
دکتر مهدی نباتی
استاد المپیاد شیمی ایران
تدریس خصوصی المپیاد شیمی مرحله اول
تدریس خصوصی المپیاد شیمی مرحله دوم

تدریس خصوصی المپیاد شیمی مرحله اول
تدریس خصوصی شیمی کنکور و المپیاد شیمی – حضوری در تهران و آنلاین در همه شهرها
تدریس خصوصی المپیاد شیمی مرحله دوم
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی