تشخیص زودهنگام و استفاده از داروهای با عملکرد اختصاصی بر روی سلولهای سرطانی
در میان بیماریهای شایع در جوامع، سرطان جزو پرهزینهترین و صعب العلاج ترین بیماریها است که تعداد زیادی مرگ و میر از مبتالایان به این بیماری در سال گزارش میشود. علت اصلی آمار بالای مرگ و میر ناشی از سرطان به ناتوانی در تشخیص و تصویر برداری از سرطانهای کوچک اولیه و درمان اختصاصی قسمت هدف قبل از متاستاز ناشی میشود. هر قدر که سرطان زودتر تشخیص داده شود، از شانس بیشتری برای درمان موفق برخوردار است. این مطلب بدین معناست که با تشخیص زودهنگام توده سرطانی و نحوه گسترش آن در بدن میتوان با اتخاذ برنامه درمانی درست از پیشرفت و گسترش سرطان جلوگیری و بافت سرطانی مورد نظر را با روشهای جراحی و یا دارویی تحت مداوا قرار داد. از سوی دیگر باید توجه داشت که داروهایی که به صورت عمومی برای درمان سرطان استفاده میشوند مانند داروهای شیمی درمانی علاوه بر سلولهای سرطانی به بافت های سالم بدن بیمار نیز آسیب میزنند، این موضوع به اختصاصیت کم عوامل سایتوتوکسیک بر روی تودههای سرطانی برمی گردد که در نتیجه عوارض جانبی شدیدی را نیز باعث می شوند. به دلیل عدم عملکرد اختصاصی داروها، باید از میزان دز (غلضت) بیشتری از دارو استفاده کرد که علاوه بر آسیب به بافتهای سالم باعث ایجاد مقاومت دارویی در سلولهای سرطانی میشود.
به این دلایل تلاشهای فراوانی از سوی محققان جهت بهبود روشهای تاثیر گذاری داروها و اختصاصیتر کردن فعالیت آنها بر روی بافت هدف با امکان دنبال کردن دارو و تصویربرداری از آن به همراه عوامل ارتقاء دهنده حساسیت این روشها انجام میشود که تهیه عوامل شناساگر و دارورسان اختصاصی برای سلولهای سرطانی از فعالترین بخشهای آن محسوب میشود.
هدف اصلی در دارورسانی هدفمند برای درمان سرطان، بالا بردن میزان دز داروی اختصاصی در ناحیه هدف و پایین ماندن غلضت آن در نواحی غیر هدف میباشد که در نتیجه آن بهبود عملکرد دارو در بافت هدف و کاهش اثرات جانبی حاصل از تماس غیر اختصاصی بافت های نرمال توسط داروهای ضد سرطان میباشد. در چند سال اخیر محققان اثبات کردهاند که سلولهای سرطانی بافت های مختلف دارای ساختار شیمیایی متفاوتی بر روی سطح خود هستند که این ساختارها را میتوان به عنوان شاخصهای شناسایی آنها در نظر گرفت. در صورتیکه لیگاندها و یا ترکیباتی طراحی و یا پیدا شوند که به طور اختصاصی بتوانند با این شاخصهای شناسایی در سطح سلولهای سرطانی اتصال برقرار نمایند، میتوان از آنها برای متمایز نمودن سلولهای سرطانی از سلولهای سالم استفاده نمود، و در صورتیکه داروهای ضد سرطان و ترکیبات آشکارساز با این لیگاندها تلفیق شوند از آنها می توان برای هدایت ترکیبات دارویی و عوامل آشکارساز به سلولهای سرطانی بهره گرفت. از این رو استفاده از ترکیباتی که بتوانند به صورت اختصاصی بر روی سلولهای گیرنده سرطانی تاثیر بگذارند و همچنین با محیط داخلی بدن سازگار باشند مانند پروتئین ها، آنتی بادی ها و پپتیدها از شاخصترین این ترکیبات هستند.
پپتیدها دارای ویژگیهای منحصر به فردی نسبت به پروتئینها و آنتی بادیها از جمله: اندازه کوچک، تهیه آسان، نشاندار کردن آسان، روشهای نشاندارکردن متنوع، سازگاری با شرایط سخت، پاکسازی سریع از خون و بافت های غیر هدف، نسبت بالای تومور به زمینه، نفوذ بالا به تومور، سمیت پایین، تمایل بالا و ویژه به گیرنده میباشند. به دلیل وجود ساختارهای متفاوت از آمینواسیدهای طبیعی و سنتزی، امکان طراحی و تهیه پپتیدهای متفاوت با ساختارهای متفاوت وجود دارد که هرکدام میتوانند به صورت عمومی و یا اختصاصی عمل کنند. از این رو تمایل فراوانی از سوی محققان و پژوهشگران برای سنتز توالیهای جدید از پپتیدهای گوناگون و شناسایی عملکرد آنها در زمینههای مختلف وجود دارد.
از جمله توالیهای پپتیدی که بسیار مورد توجه محققان قرار دارد میتوان به توالی پپتیدی شامل سه آمینو اسید طبیعی آرژنین-گلایسین-آسپارتیک اسید اشاره کرد که به اختصار آن را RGD معرفی میکنند. این توالی پپتیدی از پرکاربردترین و معروفترین توالیهایی میباشد که برای هدف قرار دادن اختصاصی تومور مورد استفاده قرار میگیرند.
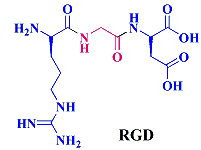
این توالی پپتیدی تمایل بالایی به اتصال اختصاصی بر روی عروق خونی بافتهای سرطانی دارند و به منظور هدف قرار دادن رگزایی در سلولهای توموری و همچنین به عنوان عامل شناساگر بافتهای خون رسان توموری استفاده میشوند.
توالی پپتیدی RGD برای نخستین بار در سال ۱۹۸۷ گزارش شد و پس از آن در تحقیقات مختلف مشخص گردید که تمایل بالایی برای اینتگرین سلولهای αvβ۳دارد. رسپتورهای αvβ۳ و αvβ۵ نقش مهمی در رشد و تکثیر تومور دارند و با رشد و تکثیر رگهای خونی در تومور باعث متاستاز در سایر سلولهای سالم و در نتیجه آلوده کردن آنها میشوند. از آنجا که توالی پپتیدی RGD به عنوان عامل شناساگر سلولهای αvβ۳ عمل میکند، میتوان با طراحی لیگاندها، اتصال داروها و ترکیباتی که قابلیت ردیابی در سلول را دارند از آنها جهت انتقال اختصاصی دارو به بافت هدف، تصویر برداری و ردیابی دارو در بدن نیز استفاده کرد. استفاده از توالی RGD به وسیله محققان دسته وسیعی از فعالیتهای آزمایشگاهی و بالینی را شامل میشود که در ادامه به برخی از آنها اشاره میشود.
در سال ۲۰۱۳ توالی پپتیدی ۹ آمینواسیدی خطی Cys-Asp-Cys-Arg-Gly-Asp-Cys-Phe-Cys به عنوان عامل انتقال دهنده داروهای دکسوروبیسین مورد استفاده قرار گرفته است. در این تحقیق با قرار گرفتن توالی RGD در ساختار پپتید از آن به عنوان عامل شناساگر بافت هدف جهت انتقال اختصاصی دارو به بافت های آلوده به تومور استفاده شد و نتایج مطلوبی از تجمع بالای دارو در بافت هدف به نسبت بافتهای زمینه مشاهده شد که در بررسی سلولی و بررسی محیط داخلی بدن موش نتایج بدست آمد.
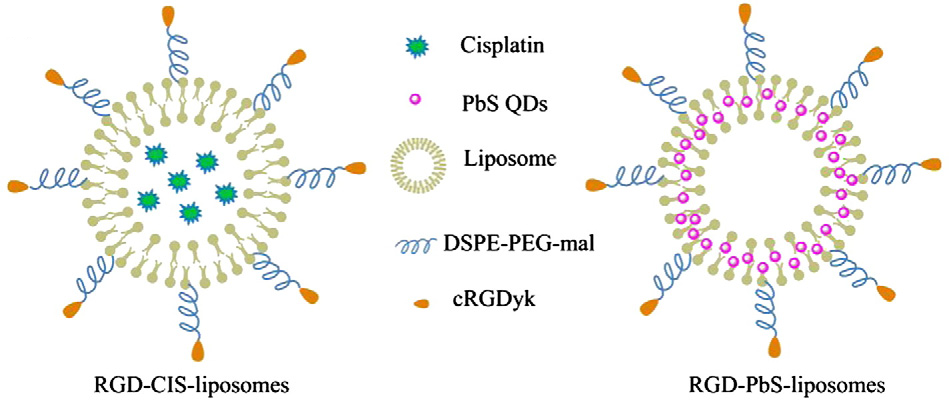
در سال ۲۰۱۴ پپتید حلقوی شده RGD که بر روی مجموعه ای از لیپوزوم حمایت شده است به عنوان عامل انتقال دهنده ترکیب سیس پلاتین عمل میکند. این مجموعه دارویی در بررسی تآثیر آن بر روی درمان و کاهش دهنده سرعت متاستاز استخوان ناشی از سرطان پروستات در محیط سلولی و بدن موش مورد استفاده قرار گرفت.
در سال ۲۰۱۴ پپتید حلقوی شده RGD حمایت شده با کامپوزیت کیتوسان/ اکسید گرافن به عنوان عامل انتقال دهنده خانواده دارویی دکسوروبیسین (DOX) مورد استفاده قرار گرفت. برای تهیه این کمپلکس دارویی، ابتدا با پیوند میان کیتوسان و پپتید حلقوی RGD به کمک عامل اتصال دهنده SPDP، عامل انتقال دهنده دارویی (RC) را تهیه کردند و از طرف دیگر با برقراری برهمکنش دوگانه پیوندهای Π-Π بین گرافن اکسید و DOX عامل دارویی و انتقالی (GO-DOX) را ایجاد کردند و در ادامه آن با ایجاد برهم کنش الکترواستاتیک میان عامل RC و GO-DOX نانو کامپوزیت انتقال دارویی RC-GO-DOX را تهیه کردند.

در چند سال اخیر با ورود نانوتکنولوژی به زمینههای تحقیقاتی مختلف، از نانوساختارها برای اتصال به پپتیدها نیز استفاده شده است و در این زمینه گزارشاتی مبنی بر تهیه توالی پپتیدی RGD متصل به نانوذرات نیز گزارش شده است به عنوان نمونه Fu و همکارانش در سال ۲۰۱۲ نانوذرات میلهای شکل طلا که با سیلیکا پوشش دهی شده بود را به توالی RGD متصل کردند (RGD-GNRs) و اثرات آن را در سرطان عمومی بدن برای گیرنده ανβ۳ مورد ارزیابی قرار دادند.

در نمونه ای دیگر در سال ۲۰۱۴ نانوذرات مغناطیس اکسید آهن با روش لایه پوشانی به وسیله نانوسیلیکای عاملدار شده به برخی از مشتقات توالی پپتیدی RGD متصل شده است. با توجه به خاصیت مغناطیسی نانوذرات اکسید آهن، امکان جذب و هدایت نانوکامپوزیت مغناطیسی به وسیله میدان مغناطیسی خارجی امکان پذیر میباشد. همچنین میتوان جهت خالص سازی و یا خارج کردن نمونه از محیط نیز از این خاصیت مغناطیسی در کامپوزیت استفاده کرد.

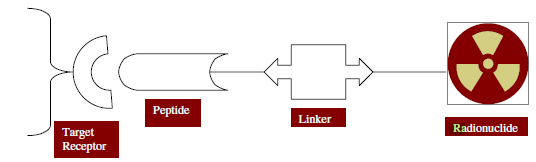
با توجه به اینکه توالی پپتیدی RGD تمایل بالایی به اتصال اختصاصی بر روی عروق خونی بافت های سرطانی دارد امکان بکارگیری مواد رادیواکتیو در طیف وسیعی از بافتهای نئوپلاستیک در بیماریهایی از جمله سرطان سینه، ملانوما بدخیم و کارسینوما سلولهای فلسی را نیز دارند. از سوی دیگر نشاندار کردن پپتیدها به وسیله رادیونوکلئیدها میتواند جهت ارتقاء ویژگیهای تصویر برداری و درمانی مورد استفاده قرار بگیرد، از اینرو در سال های اخیر پیشرفتهای زیادی در تهیه پپتید های کوچک نشاندار شده با رادیونوکلئید ها به منظور تصویر برداری تشخیصی صورت گرفته است. علت استفاده از این پپتیدها، بیان فوق العاده بعضی از گیرنده ها در سطح سلول های سرطانی نسبت به سلول های سالم می باشد که باعث عمل کردن اختصاصی آن ها می شود. در نشاندارسازی پپتیدها و استفاده از آن ها در پزشکی هسته ای خصوصآ در مورد پپتید های کوچک، انتخاب یک شلاتور و فلز رادیو اکتیو مناسب حائز اهمیت می باشد. انتخاب این عوامل بر روی تمایل باندینگ و خواص فارماکوکینتیک پپتیدها اثر می گذارد. همانطور که در شکل زیر مشاهده میشود مجموعه پپتیدی به همراه مواد رادیواکتیو به صورتی طراحی میشود که به عنوان عامل اختصاصی به بافت و سلولهای هدف اتصال برقرار کند و بیشترین تاثیر را در ناحیه مورد نظر داشته باشد.
رادیونوکلئیدهای فراوانی در نشاندار سازی پپتیدها به منظور موارد تشخیصی مورد استفاده قرار میگیرد که از مرسوم ترین و پرکاربردترین آنها میتوان به ۹۹mTc، ۱۸F، ۱۱۱In، ۶۸Ga، ۶۴Cu و … اشاره کرد. انتخاب رادیونوکلئید به خواص فیزیکی و هستهای، در دسترس بودن و قیمت آن بستگی دارد. بیشتر از هشتاد درصد از محققان رادیوفارماسیوتیکس در پزشکی هستهای از تکنسیم استفاده میکنند و علت آن را میتوان در ویژگی های بارز آن از قبیل: مناسب بودن نیمه عمر برای سنتز ترکیب، تصویر برداری و کاهش دز تابشی موثر به بیمار، در دسترس بودن ژنراتور آن و … دانست.
پپتیدها با هر دو روش مستقیم و غیر مستقیم میتوانند با تکنسیم نشاندار شوند. در روش مستقیم، تکنسیم با قسمتی از اتمهای الکترون دهنده از آمینو اسیدهایی که در ساختار اولیه پپتید وجود دارند کمپلکس می دهد. در روش غیر مستقیم تکنسیم با عوامل کملپکس دهنده دو جانبه به عنوان BFC که به پپتید متصل شده اند به عنوان محل اتصال با رادیونوکلئید کمپلکس می دهد. ویژگی این روش این است که با انتخاب هر اسید آمینه میتوان زنجیره های جانبی را تغییر داد و به تناسب آن میتوان اندازه، بار و چربی دوستی کمپلکس را سازماندهی کرد. پپتیدهای نشاندار شده با این روش از هر دو سیستم کلیوی و کبدی به تناسب توالی مورد هدف و زنجیره جانبی توالی نشاندار سازی خروج را نشان دادند.
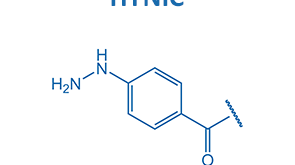
از میان تکنیکهای فراوان برای تصویربرداری آنکولوژی و بیماریهایعفونی، تکنیکهای پزشکی هستهای از جمله SPECT و PET اهمیت زیادی دارند. همانطور که گفته شد از مهمترین رادیونوکلئیدهایی که به منظور تصویربرداری تشخیصی بیشتر مورد استفاده قرار میگیرد میتوان تکنسیم را نام برد. به منظور استفاده از این رادیونوکلئید برای تصویر برداری از طریق روش SPECT و اتصال به پپتیدها و آنتی بادیها، از شلاتور هایی نظیر MAG3، HYNIC،MAG2 و گروههایی از جنس اسید آمینه به منظور تشکیل بار الکترونی مناسب استفاده کردند. با توجه به اهمیت و کاربردهای متنوع توالی RGD از این توالی پپتیدی در فرایندهای انتقال رادیونوکلئیدها استفاده میشود که در ادامه به برخی از گزارشات منشر شده اشاره میشود.
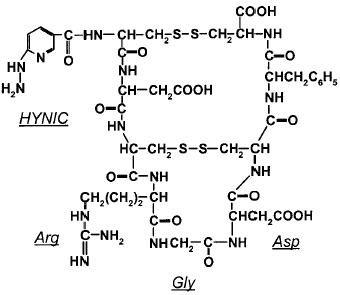
در سال ۲۰۰۲ پپتید حلقوی شده RGD جهت بررسی عملکرد بر روی سلولهای گیرنده ανβ۳ سنتز شدند و جهت دنبال کردن و امکان تصویر برداری این گروه پپتیدی با رادیونوکلئید ۹۹mTc نشاندار شد. در این گزارش امکان نشاندار شدن در این پپتید با اتصال این پپتید به گروه شلات کننده HYNIC صورت گرفت که این شلاتور به خوبی با ۹۹mTc کمپلکس میدهد.
در سال ۲۰۰۴ پپتید حلقوی شده RGD با اتصال به گروه فلورو بنزوئیل، به وسیله رادیونوکلئید ۱۸F نشانه گذاری شد و برای بررسی عملکرد این مجموعه پپتیدی در تومور مغزی مورد استفاده قرار گرفت. با وجود رادیونوکلئید ۱۸F در مجموعه پپتیدی امکان ردیابی دارو در بدن و تصویر برداری PET بر روی آن وجود دارد.
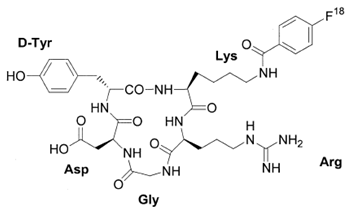
در سال ۲۰۱۱ پپتید حلقوی شده RGD به گونه ای طراحی شده است تا رادیونوکلئوتید ۱۸F به آن متصل شود و ارزیابی تاثیر آن بر روی سلولهای گیرنده ανβ۳ و امکان تصویر برداری PET در آن فراهم شود. اتصال ۱۸F بر روی توالی پپتیدی RGD این امکان را میدهد تا به وسیله تصویر برداری نحوه اتصال و چگونگی پخش شدگی پپتید در محیط بدن نمایان شود و رفتار آن قابل ردیابی باشد. در این گزارش همچنین عملکرد این پپتید در اتصال با رادیونوکلئوتیدهای ۹۹mTC, 123I, 131I, 111In, 67Ga, 201Tl که امکان تصویر برداری به روش SPECT در آنها وجود دارد نیز بررسی شده است. اتصال رادیونوکلئوتیدهای SPECT به پپتیدهای RGD به وسیله عوامل شلات کننده مانند DOTA, HYNIC, NOTA انجام شده است و میزان جذب پپتید نشاندار شده در اندام مختلف در موش و همچنین میزان IC50 برای آنها نیز گزارش شده است. این پپتید نشاندارسازی پایدار، پاک سازی خونی سریع، دفع بیشتر از طریق سیستم کلیوی و نسبت تومور به زمینه بالاتری نسبت به دیگر عوامل شلات کننده از خود نشان داد.
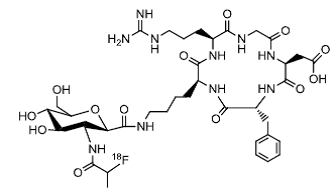
در سال ۲۰۱۵ بر روی دو نمونه پپتید دیمر حلقوی شده RGD که به گالاکتوز و شلاتور دوتا متصل شده است، رادیونوکلئوتید ۱۱۱In نشانه گذاری شده و اثرات بیولوژیک آن مورد بررسی قرار گرفت. دو نمونه مورد بررسی ۱۱۱In(DOTA-Galacto-RGD2) و ۱۱۱In(DOTA-3P-RGD2) بر روی گیرنده ανβ۳ در توده سرطان سینه مورد آزمایش قرار گرفتند و اثرات آنان گزارش شدند نشاندارسازی پایدار، پاک سازی خونی سریع، و نسبت تومور به زمینه مطلوبی از خود نشان داد.
نویسنده مقاله: خانم دکتر حمیده صباح نو متخصص داروسازی هسته ای
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی

سلام اگه ممکنه منابع و رفرنس نوشته هاتون رو میتونم داشته باشم؟