آموزش کل فرمول های شیمی کنکور و المپیاد با دکتر مهدی نباتی
دانش آموزان عزیزم در این مقاله می خواهم یک فرمول کنکوری طلایی و خیلی کار راه انداز را بهتون آموزش بدم. فرمولی که به وسلیه اون میتونین بین مقادیر حل شونده و حلال در یک محلول ارتباط برقرار کنید.
این فرمول در مسائلی به کار می رود که اگر بخواهید با روش های کتاب درسی یا روش های دیگر حل کنید مطمئنا برای حل فقط یک مسئله بایستی بالای ۱۰ دقیقه وقت بگذارید. اما با این فرمول جادویی که در ادامه در قالب یک تست کنکوری به شما آموزش خواهم داد، خواهید توانست در کمتر از ۳۰ ثانیه به جواب برسید.
پس با من همراه شوید….
تست کنکوری شیمی
برای تهیه محلول ۲٫۰۳ مولار با چگالی ۱٫۰۱۷ گرم بر میلی لیتر از ۳۰ گرم استیک اسید به چند میلی لیتر آب نیاز است؟
(C = 12 و H = 1 و O = 16)
الف: ۴۴۰٫۵
ب: ۲۲٫۰۵
ج: ۲۲۰٫۵
د: ۴۴٫۰۵
پاسخ:
دانش آموزان عزیزم وقتی چنین تیپ سوالی رو در کنکور دیدید به هیچ وجه نترسید. خیلی راحت از فرمول زیر استفاده کنید و سریع به جواب برسید:
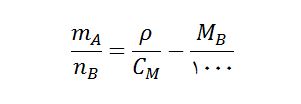
جرم حلال با نماد mA بر حسب کیلوگرم
تعداد مول ماده حل شونده با نماد nB بر حسب مول
چگالی محلول با نماد ρ بر حسب گرم بر میلی لیتر
غلظت محلول با نماد CM بر حسب مول بر لیتر
جرم مولی حل شونده با نماد MB بر حسب گرم بر مول
ابتدا جرم مولی و مول حل شونده (اسید استیک) را حساب می کنیم:
MB = 60 g/mol
nB = 30 / 60 = 0.5 mol
حالا خیلی سریع داده های مسئله را در فرمول می گذاریم تا جرم حلال (آب) را بر حسب کیلوگرم به دست آوریم:
mA / 0.5 = (1.017 / 2.03) – 0.06
⇓
mA = 0.2205 Kg
⇓
mA = 220.5 g
بنابراین تهیه این محلول مقدار ۲۲۰٫۵ گرم آب نیاز است. از طرفی چون چگالی آب برابر با ۱ گرم بر میلی لیتر می باشد، پس حجم آب مورد نیاز هم برابر با ۲۲۰٫۵ میلی لیتر می شود.
VA = 220.5 mL
حال کردین؟؟!!!!
گزینه صحیح:
بنابراین گزینه ج جواب صحیح برای این سوال کنکور می باشد.

تدریس خصوصی و گروهی شیمی دهم و یازدهم و دوازدهم در تهران
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی


