روش های تستی محاسبه غلظت های ثابت و غیرثابت
تدریس خصوصی آنلاین شیمی کنکور
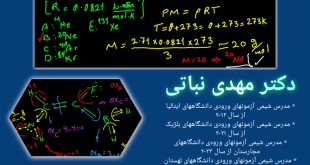
دکتر مهدی نباتی – استاد شیمی رتبه های برتر ایران
نمونه تدریس شیمی نباتی نمونه تدریس شیمی کنکور نباتی نمونه تدریس شیمی دکتر نباتی نمونه تدریس شیمی کنکور دکتر نباتی نمونه تدریس شیمی استاد نباتی نمونه تدریس شیمی کنکور استاد نباتی نمونه تدریس شیمی مهدی نباتی نمونه تدریس شیمی کنکور مهدی نباتی نمونه تدریس شیمی دکتر مهدی نباتی نمونه تدریس شیمی کنکور دکتر مهدی نباتی نمونه تدریس شیمی استاد مهدی نباتی نمونه تدریس شیمی کنکور استاد مهدی نباتی
دانش آموزان عزیزم سلام …
محاسبه غلظت محلول ها یکی از مباحث بسیار مهم شیمی کنکور است که نه تنها ۲ سوال مستقیم از این مبحث در کنکور طرح می شود، بلکه پایه اصلی محاسبات و تحلیل مباحث بسیاری از مباحث در فصل های دیگر کتاب های درسی شیمی است که از آن جمله می توان به فصل اسیدها و بازها، مسائل صابون ها، مسائل ترکیبات آلی، مسائل الکتروشیمی و همچنین مسائل واکنش های تعادلی است. یعنی می توان گفت که حداقل ۶ مساله از این مباحث بر پایه محاسبات غلظت محلول ها است.
به همین خاطر من همیشه در کلاس ها به دانش آموزان می گویم که اگر دانش آموزی به رتبه برتر شدن و کسب درصدهای بالا در درس شیمی کنکور فکر می کند بایستی به مهارت فوق العاده بالایی در دو مبحث استوکیومتری و محاسبات انواع غلظت ها برسد.
متاسفانه باز کتاب درسی در این مبحث هم خیلی کم کاری کرده و نه تنها خوب توضیح نداده و ناقص بیان کرده بلکه بسیاری از مباحث را نیز مبهم مطرح کرده است. فکر کنم طراحان محترم کتاب های درسی این تفکر را دارند که دانش آموزان، شیمیدان به دنیا می آیند و خودشان با خواندن این حجم از مباحث ناقص و مبهم به یادگیری کامل دست پیدا می کنند.
*** یکی از مباحثی که به صورت مبهم چه در کتاب های درسی و چه در کتاب های آموزشی شیمی مطرح شده، مبحث انواع غلظت های ثابت و غیرثابت است. برای مثال در فصل های ۱ و ۴ شیمی دوازدهم کنکور به دانش آموز گفته می شود که در رابطه ثابت های تعادلی فقط غلظت محلول ها و گازها قرار داده می شود و برای مواد جامد و مایع خالص در این رابطه ها جایی نداریم چون غلظت آن ها ثابت است.
اما نگفته اند که اصلا غلظت ثابت یعنی چه؟؟!! اصلا نگفته اند که آیا مواد خالص دارای غلظت هستند یا نه؟؟!!
*** دانش آموزان عزیزم به همین خاطر امروز در این مقاله به طور کامل و یک بار برای همیشه انواع غلظت های ثابت و غیرثابت و روش محاسبه غلظت برای محلول ها و همچنین مواد خالص (جامد، مایع و گاز) را یاد خواهیم گرفت.
*** دانش آموزان عزیزم در فیلم آموزشی زیر می توانید این درسنامه را مشاهده کرده و روش های تستی انواع محاسبات برای غلظت ها را یاد بگیرید. البته در ادامه مقاله نیز، سعی می کنم به بهترین نحو ممکن و به ساده ترین بیان این موضوع و مبحث را برای شما عزیزان آموزش دهم.
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
نمونه تدریس شیمی استاد نباتی – محاسبه غلظت های ثابت و غیرثابت
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
محاسبه غلظت محلول ها
دانش آموزان عزیزم، غلظت محلول های آبی جزو غلظت های غیر ثابت است و می تواند در حجم های متفاوتی از محلول حاوی مقادیر متغیری از حل شونده ها باشند.
دو نوع غلظت بسیار مهم برای محلول ها داریم: غلظت مولی (مولاریته) و غلظت معمولی.
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
غلظت مولی:
مولاریته (CM) محلول ها از تقسیم مقدار ماده حل شونده (n) بر حسب مول (mol) بر حجم محلول (V) بر حسب لیتر (L) به دست می آید. بنابراین واحد یا یکای غلظت مولی برابر با مول بر لیتر (mol/L) می باشد.
CM = n / V
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
غلظت معمولی:
غلظت معمولی (C) محلول ها از تقسیم جرم ماده حل شونده (m) بر حسب گرم (g) بر حجم محلول (V) بر حسب لیتر (L) به دست می آید. بنابراین واحد یا یکای غلظت مولی برابر با گرم بر لیتر (g/L) می باشد.
C = m / V
*** غلظت معمولی (C) محلول ها با چگالی اشتباه گرفته نشود.
چگالی (ρ) از تقسیم جرم محلول (m) بر حسب گرم (g) بر حجم محلول (V) بر حسب لیتر (L) به دست می آید. بنابراین واحد یا یکای چگالی هم برابر با گرم بر لیتر (g/L) می باشد.
بنابراین تفاوت چگالی با غلظت معمولی در صورت کسر محاسبات می باشد که برای غلظت معمولی، جرم حل شونده می باشد و برای چگالی، جرم کل محلول می باشد.
ρ = m / V
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
رابطه طلایی غلظت معمولی و غلظت مولار:
غلظت معمولی (C) محلول ها از ضرب مولاریته (CM) محلول ها در جرم مولی حل شونده (M) بر حسب گرم بر مول (g/mol) به دست می آید.
C = M × CM
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
محاسبه غلظت مواد جامد و مایع خالص
دانش آموزان عزیزم، غلظت مواد مایع و جامد خالص جزو غلظت های ثابت است. این بدین معنی است که مقدار یک ماده خالص هر چقدر هم که کم و زیاد باشد، غلظتش ثابت است و تغییری نمی کند.
مولاریته (CM) مواد جامد و مایع خالص از تقسیم چگالی (ρ) بر حسب گرم بر لیتر (g/L) بر جرم مولی (M) بر حسب لیتر (g/mol) به دست می آید. بنابراین واحد یا یکای غلظت مولی مواد جامد و مایع خالص برابر با مول بر لیتر (mol/L) می باشد.
CM = ρ / M
*** توجه شود که چون چگالی به فشار و دما وابسته است و چگالی یک ماده خالص با تغییر دما و یا فشار تغییر می کند. لذا غلظت مولار یک ماده جامد یا مایع خالص در هر دما و فشار معین، یک مقدار مشخص بوده و ثابت است.
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
محاسبه غلظت مواد گازی خالص
دانش آموزان عزیزم، غلظت مواد گازی خالص جزو غلظت های غیر ثابت است. این بدین معنی است که غلظت گاز خالص به دما و فشار وابسته است.
مولاریته (CM) مواد گازی خالص از تقسیم فشار (P) با واحد اتمسفر (atm) بر ثابت جهانی گازها (R) و دما (T) به ترتیب با یکاهای L.atm/mol.K و کلوین (K) به دست می آید. بنابراین واحد یا یکای غلظت مولی مواد گازی خالص برابر با مول بر لیتر (mol/L) می باشد.
CM = P / (R × T)
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
سوال تستی از مبحث غلظت محلول ها
۰٫۴ مول سدیم برمید در ۶۴۰ میلی لیتر آب خالص حل شده است. غلظت محلول چند گرم بر لیتر است؟
(Na=23 و Br=80)
الف: ۶۴٫۳۷۵
ب: ۳۳٫۵۴۹
ج: ۱۲٫۸۸۸
د: ۸۰٫۹۵۱
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
پاسخ:
ابتدا غلظت مولاریته محلول را به دست می آوریم. فقط توجه داشته باشیم که وقتی یک ماده جامد در یک حلال مایع حل می شود، حجم محلول به تقرییب با حجم حلال برابر است. بنابراین در این سوال حجم محلول ۰٫۶۴ لیتر در نظر گرفته می شود.
CM = n / V ⇒ CM = 0.4 / 0.64 ⇒ CM = 0.625 mol/L
حالا از طریق فرمول تستی که در بالا بهتون یاد دادم میتونین غلظت مولار را به غلظت معمولی (گرم بر لیتر) که سوال خواسته، تبدیل کنید.
C = M × CM ⇒ C = 103 × ۰٫۶۲۵ ⇒ C = 64.375 g/L
بنابراین گزینه الف پاسخ صحیح این سوال تستی می باشد.
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
سوال تستی از مبحث غلظت مواد خالص
غلظت آب خالص در دمای ۴ درجه سانتی گراد چند مول بر لیتر است؟
(H=1 و O=16)
الف: ۵۵٫۵۵
ب: ۲۲٫۲۱
ج: آب خالص غلظت مشخص ندارد.
د: نمی توان برای مواد خالص از جمله آب خالص، غلظت تغیین کرد.
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
پاسخ:
می دانیم که چگالی آب خالص در دمای ۴ درجه سانتی گراد و فشار ۱ اتمسفر برابر با ۱۰۰۰ گرم بر لیتر می باشد.
غلظت آب خالص از فرمول تستی گفته شده در بالا (تقسیم چگالی بر جرم مولی) به دست می آید:
CM = ρ / M ⇒ CM = 1000 / 18 ⇒ CM = 55.55 mol/L
بنابراین گزینه الف پاسخ صحیح این سوال تستی می باشد.
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
سوال تستی از مبحث غلظت گاز خالص
غلظت گاز اکسیژن در فشار ۳ اتمسفر و دمای ۲۷ درجه سانتی گراد چند گرم بر لیتر است؟
(R=0.0821 L.atm/mol.K)
الف: ۳٫۹
ب: ۷٫۸
ج: ۲٫۵
د: ۱۰٫۱
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
پاسخ:
ابتدا دمای داده شده را به دمای کلوین تبدیل می کنیم:
T = θ + ۲۷۳ ⇒ T = 27 + 273 ⇒ T = 300 K
سپس غلظت مولاریته گاز اکسیژن خالص را به دست می آوریم:
CM = P / (R × T) ⇒ CM = 3 / (0.0821 × ۳۰۰) ⇒ CM = 0.122 mol/L
حالا غلظت مولار را به غلظت معمولی (گرم بر لیتر) تبدیل می کنیم.
C = M × CM ⇒ C = 32 × ۰٫۱۲۲ ⇒ C = 3.9 g/L
بنابراین گزینه الف پاسخ صحیح این سوال تستی می باشد.
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
تدریس خصوصی شیمی کنکور در شیراز تدریس شیمی کنکور در شیراز تدریس خصوصی شیمی در شیراز تدریس شیمی در شیراز تدریس آنلاین شیمی کنکور در شیراز
با آرزوی موفقیت برای شما دانش آموزان عزیز
تدریس خصوصی شیمی کنکور در تهران تدریس شیمی کنکور در تهران تدریس خصوصی شیمی در تهران تدریس شیمی در تهران تدریس آنلاین شیمی کنکور در تهران
تدریس خصوصی شیمی کنکور در تهران تدریس شیمی کنکور در تهران تدریس خصوصی شیمی در تهران تدریس شیمی در تهران تدریس آنلاین شیمی کنکور در تهران
استاد شیمی کنکور و المپیاد ایران
تدریس خصوصی شیمی کنکور در تهران تدریس شیمی کنکور در تهران تدریس خصوصی شیمی در تهران تدریس شیمی در تهران تدریس آنلاین شیمی کنکور در تهران

تدریس خصوصی آنلاین شیمی کنکور تهران مشهد اصفهان کرج شیراز تبریز قم اهواز کرمانشاه ارومیه رشت زاهدان همدان کرمان یزد اردبیل بندرعباس اراک اسلامشهر ساری بابل
تدریس خصوصی آنلاین شیمی کنکور و المپیاد شیمی ایران
تدریس خصوصی آنلاین شیمی کنکور تهران مشهد اصفهان کرج شیراز تبریز قم اهواز کرمانشاه ارومیه رشت زاهدان همدان کرمان یزد اردبیل بندرعباس اراک اسلامشهر ساری بابل
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی