آموزش خصوصی شیمی با بهترین دبیر شیمی کنکور تهران
سوال امتحانی شیمی دهم مدرسه دخترانه آیین معرفت تهران
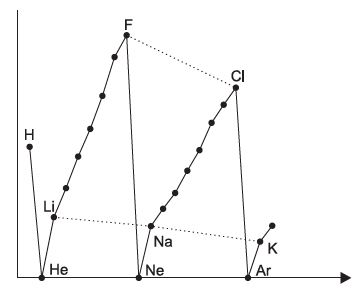
نمودار الکترونگاتیوی عناصر در زیر داده شده است. این نمودار را آنالیز و تحلیل کرده و ارتباط معناداری را برای این خصلت در عناصر جدول تناوبی بیابید.
پاسخ:
دانش آموزان عزیزم، این نموداری که در سوال امتحانی دبیرستان دخترانه آیین معرفت تهران داده شده است، یکی از نمودارهای بسیار مهم در شیمی است که چندین بار در آزمون های کنکور سراسری و المپیادهای علمی مورد سوال قرار گرفته است. یعنی می توان گفت که یک نمودار بسیار سوال خیز است. از این نمودار که نشان دهنده تغییرات خاصیت الکترونگاتیوی بر اساس افزایش عدد اتمی عناصر می باشد، می توان نکات بسیار مهم زیر را نتیجه گرفت:
الف: خاصیت الکترونگاتیوی عناصر یا گازهای نجیب برابر صفر می باشد و دلیل آن پر بودن لایه ظرفیت این عناصر از الکترون می باشد و دیگر تمایلی برای گرفتن الکترون ندارند.
He = Ne = Ar = Kr = Xe = Rn = 0
ب: در یک دوره از چپ به راست با افزایش عدد اتمی، الکترونگاتیوی هم افزایش پیدا می کند.
Li < Be < B < C < N < O < F
ج: در یک گروه تناوبی از بالا به پایین خاصیت الکترونگاتیوی کاهش پیدا می کند.
Li > Na > K > Rb > Cs
د: در بین عناصر گروه ۱ تا ۱۷ جدول تناوبی، فلوئور بالاترین قدرت الکترونگاتیوی را دارد.
ه: در بین عناصر گروه ۱ تا ۱۷ جدول تناوبی، سزیم کمترین قدرت الکترونگاتیوی را دارد.
و: منحنی افزایش الکترونگاتیوی، از هر دوره به دوره بعدی منقبض تر می شود.
ز: قدرت الکترونگاتیوی هیدروژن بین کربن و بور می باشد.
ح: قدرت الکترونگاتیوی کلر کمتر از فلوئور و اکسیژن می باشد.
نکته بسیار مهم: دانش آموزان عزیزم، با استفاده از میزان اختلاف الکترونگاتیوی عناصر می توان قطبیت یک پیوند و نوع جهت قطبش پیوندی را پیش بینی کرد.

تدریس خصوصی و گروهی شیمی دهم و یازدهم و دوازدهم در تهران
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی



