همانطور که در مقاله قبلی ذکر شد از میان آپتامر ها، GRO ها یا RNA و DNA های غنی از گوانین اغلب خواص بیولوژیکی و بیوفیزیکی متمایزی تری دارند که به حضور فراوان گوانین ها و گرایش الیگونوکلئوتید به تشکیل ساختار کواردپلکس بر می گردد. استفاده از اسکلت های مقاوم در برابر نوکلئاز مانند آنالوگ های فسفوروتیوآت یا قرار دادن گروه های آمین یا فلوئور در موقعیت ‘۲ پیریمیدین ها در بسیاری از الیگونوکلئوتید های اصلاح نشده (فسفودی استر) ضروری می باشد. اما در مورد آپتامر های کواردپلکس ضروری نیست. همچنین علاوه بر ایمونوژن نبودن، پایداری حرارتی و جذب سلولی بیشتری را در مقایسه با توالی های بدون ساختار از خود نشان می دهند.
از میان آنها می توان بهDNA آپتامر AS1411 به عنوان یک داروی ضد سرطان امیدوار کننده اشاره کرد که به پروتئین نوکلئولین در غشای پلاسمایی باند می شود. نوکلئولین به میزان زیادی در سلول هایی که به طور مداوم تقسیم می شوند از قبیل سلول های سرطانی بیان می شوند. این پروتئین در سطح سلول های توموری پستان، پروستات، کارسینومای کلیه و ریه، و لوسمی حاد لنفوییدی بیان بالایی در مقایسه با سلول های نرمال دارد. بنابراین به عنوان یک کاندیدای مناسب برای درمان اختصاصی سرطان از طریق داخل سازی لیگاند های خاص می باشد.
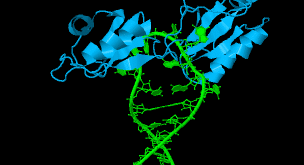
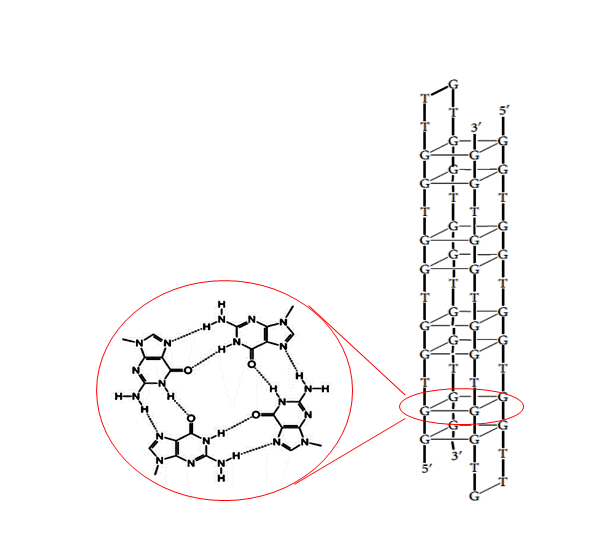
در روزهای اولیه از تحقیقات آنتی سنس تعدادی از پژوهشگران گزارش کردند که فعالیت بیولوژیکی مورد انتظار برخی از الیگونوکلئوتید ها مانند مهار رشد سلولی یا آپوپتوز با مکانیسم آنتی سنس میانجی گری نشده بلکه به حضور فراوان گوانین و گرایش آنها به تشکیل ساختار سه بعدی و پایدار G-کوارتت بر می گردد (شکل ۶-۱). آرایش مربع مسطح که با تشکیل پیوند های هیدروژنی میان چهار گوانین ایجاد می شود.
در دهه ۱۹۹۰ گروهی از محققان توانایی توالی های متعددی از الیگونوکلئوتید های فسفودی استر غنی از گوانین را در مهار رشد سلول های توموری، به منظور گسترش درمان های انتخابی تر سرطان، در محیط کشت سلولی مورد ارزیابی قرار دادند. به این منظور از رده سلول های سرطانی پروستات (DU145)، پستان (MDA-MB-231, MCF-7) و دهانه رحم (HeLa) استفاده شد. همچنین آنها الیگونوکلئوتید ها را با فسفر ۳۲ به منظور ارزیابی میزان آپتیک سلولی نشاندار کردند. دو الیگونوکلئوتید GRO29A و GRO15A به طور مداوم، تکثیر سلولی را در تمام رده های سلولی فوق مهار کردند. اما به جز رده سلولی MCF-7 که اثر آنها مشابه بود، GRO29A اثر مهاری قوی تری از خود نشان داد. GRO29A یک الیگوداکسی نوکلئوتید فسفودی استر با گروه آمینو آلکیل در انتهای ‘۳ است. تحقیقات نشان داد که اصلاح ‘۳برای مقاومت نوکلئازی و فعالیت آن و دم انتهای ‘۵ GRO29A (TTT) نیز برای فعالیتش ضرورتی ندارد. اما ساختار G-کواردپلکس یک نقش کلیدی را در فرایند های بیولوژیک از قبیل مهار تکثیر و رشد در بسیاری از تومور ها، مدوله کردن فعالیت تلومراز و همانندسازی DNA در برون تنی ایفا می کند. بنابراین مطالعات پیش بالینی با استفاده از توالی ۲۶ الیگومری که AGRO100 نامیده شد دنبال گردید. تمام آنالیز هایی انجام شده نشان داد که AGRO100 مشابه با GRO29A عمل می کند. این توالی در سال ۲۰۰۵، AS1411 نام گرفت.
آپتامر AS1411(2 gmol-1.MW:6104) یک GRO آپتامر با ساختار G-کواردپلکس است که اثر مهاری را در رشد و تکثیر سلول های توموری از خود نشان می دهد. مطالعات نشان داد که GRO های دارای این ساختار به پروتئین های ویژه ای باند می شوند که فعالیت های بیولوژیک آنها به این اتصال وابسته است. این پروتئین در هسته و سیتوپلاسم و به ویژه در میان پروتئین های غشای پلاسمایی سلول ها قابل تشخیص بود. Bats و همکارانش در سال ۱۹۹۹ حدس زدند که نوکلئولین ها به عنوان رسپتور برای الیگونوکلئوتید های غنی از گوانین محسوب می شوند. این پروتئین به توالی های ویژه G- کوادپلکس باند می شود و چون AS1411 یک ساختار G- کوارتت پایدار تشکیل می دهد، افینیتی بالا و اتصال اختصاصی به نوکلئولین را توجیه می نمود. مکانیسم عملکرد که آپتامر آنتی نوکلئولین AS1411 ، که به طور کاملا اتفاقی توسط Bates و همکارانش کشف شد، بدین صورت گزارش شد که این آپتامر به عنوان یک تله مولکولی با نوکلئولین بر سر اتصال به bcl-2 mRNA رقابت کرده و اتصال نوکلئولین به bcl-2 mRNA را مهار می کند و ناپایداری bcl-2 mRNA و آپوپتوز سلول را سبب می شود. چون سلول های نرمال بیان بسیار کمی از نوکلئولین را دارند و برای بقا به پایداری bcl-2 mRNA وابسته نیستند درنتیجه از اثرات آپتامر نیز در امان خواهند ماند. از دیگر مکانیسم های عملکرد ضد توموری AS1411 می توان به مهار مسیر سیگنالی NF-κB اشاره کرد. As1411 یک کمپلکس داخل سلولی با NF-κB و نوکلئولین تشکیل و بنابراین از فعال شدن NF-κB و در نتیجه از همانند سازی DNA جلوگیری کرده، توقف چرخه سلولی و آپوپتوز را سبب می شود.
علاوه بر مطالعات انجام شده به منظور بررسی توانایی آپتامر آنتی نوکلئولین در درمان انواع سرطان، عملکرد AS1411 به عنوان یک پروب تصویربرداری از سلول های سرطانی نیز مورد بررسی قرار گرفت. Hwang و همکارانش آپتامر را با نانوذرات MF گانژوگه کردند و با گالیم ۶۷ نشاندار نموده MF-AS1411-NOTA نشاندار شده با ۶۷Ga سیترات: MFR-AS1411 و جذب آن را در سلول های گلیومای رت (C6) با استفاده از میکروسکوپی کانفوکال فلورسنت مشاهده کردند. برای ردیابی درون بدنی، MFR-AS1411 به موش نود دارای تومور زنوگرفت C6 تزریق و با تکنیک سانتی گرافی و MRI بررسی شد. داده های in vitro و in vivo این محققان نشان داد که آپتامر ضد نوکلئولین می تواند نانوذرات را به سلول های سرطانی بیان کننده نوکلئولین انتقال دهد و به عنوان یک معرف تصویر برداری غیر تهاجمی به کار گرفته شود. نشاندار کردن AS1411 با فلوئور-۱۸ از طریق کانژوگاسیون آپتامر با N-سوکسینیمیدیل ۴-فلوروبنزوات ([۱۸F] FSB) توسط گروه Jungling گزارش شد ولی توانایی آن به منظور اهداف تشخیصی مورد بررسی قرار نگرفته است. علاوه بر این، اخیرا نتایج رضایت بخش invitro و invivo برای آپتامر نشاندار با ۶۴Cu نیز نشان داد که احتمالا ۶۴Cu-CB-TE2A-AS1411 بتواند به عنوان یک تریسر جدید PET برای تصویربرداری از سرطان ریه باشد.
نویسنده مقاله: خانم دکتر زهره نوع پرست متخصص داروسازی هسته ای
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی