روش مطالعه فوق حرفه ای شیمی کنکور با دکتر نباتی
۱۰۰ زدن شیمی کنکور در یک ماه به همراه مباحث تست خیز
دانش آموزان عزیزم، بارها در مقالات مختلف اشاره کرده ام که در شیمی علاوه بر اینکه بایستی روی تقویت قدرت تحلیلتان کارکنید، باید فرمول ها و تکنیک ها و رابطه های کنکوری و فوق حرفه ای را نیز بلد باشید. چون علاوه بر اینکه باید قدرت تست زنی بالایی داشته باشید، باید بتوانید در زمان یک دقیقه به هر سوال در آزمون کنکور سراسری جواب دهید.
به همین خاطر، قدرت تحلیل بالا و آشنایی به تکنیک های کنکوری دو بال لازم برای اوج گرفتن تراز درس شیمی شما در کنکور است.
امرور در این مقاله می خواهم یک رابطه بسیار مهم کنکوری در ارتباط با نحوه پر شدن زیرلایه های الکترونی را در اتم ها به شما آموزش دهم.
لازم به ذکر است که روش تحلیل همین مبحث را قبلا در یک مقاله جداگانه به شما آموزش داده ام. به همین خاطر دیگر در اینجا تکرار نمی کنم و فقط این رابطه کنکوری را به شما آموزش خواهم داد!!
رابطه شیمی کنکوری بسیار مهم
دانش آموزان عزیزم الکترون ها درون ترازها یا زیرلایه های الکترونی به صورتی قرار می گیرند که ابتدا زیرلایه های با انرژی کمتر پر شوند. این تحوه پر شدن زیرلایه های الکترونی با استفاده از ۳ قاعده بسیار مهم انجام می گیرد:
الف: قاعده کلچکووسکی (که به اشتباه در کتاب درسی به نام قاعده آفبا گفته شده است) که این قاعده می گوید الکترون ها تمایل دارند در زیرلایه هایی با n + l کمتر قرار بگیرند. و اگر دو زیرلایه دارای n + l برابر باشند، الکترون ابتدا در زیرلایه با n کمتر قرار می گیرد.
ب: قاعده آفبا که اشاره می کند الکترون ها به صورت یکی یکی درون زیرلایه ها قرار می گیرند و تا ظرفیت زیرلایه ای تکمیل نشده باشد، الکترونی وارد زیرلایه بعدی نخواهد شد.
ج: قاعده پایداری ترازهای پر و نیمه پر
هر ۳ این قاعده ها قبلا در مقالات قبلی به طور کامل تحلیل شده و آموزش داده شده است.
بر اساس این قاعده ها می توان به یک رابطه کنکوری بسیار مهم برای پر شدن زیرلایه های الکترونی اتم ها رسید:
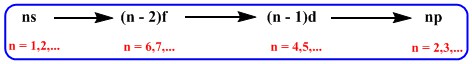
بنا به این رابطه بسیار مهم، ترازها یا زیرلایه های الکترونی به این صورت شروع به پر شدن خواهد کرد:
۱s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
نکته بسیار بسیار مهم و حیاتی:
دانش آموزان عزیزم توجه کنید که این ترتیب فقط برای پر شدن الکترون ها می باشد!!! به محض اینکه الکترون ها در این زیرلایه ها قرار گرفتند، زیرلایه ها به ترتیب حالت اصلی خود بازخواهند گشت
برای مثال، فرض کنیم در اتمی، آخرین زیرلایه ای که الکترون در آن قرار می گیرد زیرلایه ۳d باشد. الکترون ها به ترتیب بالایی درون زیرلایه ها پر خواهند شد. ولی به محض ابنکه زیرلایه ها پر شدند، زیرلایه ها به حالت اصلی یعنی حالت زیر بازآرایی خواهند کرد:
۱s, 2s, 2p, 3s, 3p, 3d, 4s
اما چطور از این قاعده استفاده خواهیم کرد؟!
این نکته کنکوری بسیار مهم می گوید که موقع پر شدن، ابتدا زیرلایه ۴s پر می شود و بعد زیرلایه ۳d شروع به پر شدن می کند.
اما بعد از پر شدن به حالت اصلی برمی گردد. یعنی موقع یونش، الکترون ابتدا از زیرلایه ۴s جدا خواهد شد نه از زیرلایه ۳d.
حالا اگر مبحث را خوب یاد گرفته اید، به یکی از سوالات کنکور سراسری سال های اخیر جواب بدهید:
سوال شیمی دهم کنکور سراسری
آخرین زیرلایه ای که قبل از زیرلایه ۵d از الکترون اشغال شده است، کدام زیرلایه الکترونی می باشد؟
الف: ۶s
ب: ۶p
ج: ۴f
د: ۵f
موفق باشید

تدریس خصوصی و تحلیلی شیمی دهم و یازدهم و دوازدهم در تهران
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی



