تدریس کامل تمام نکات شیمی کنکور تجربی و ریاضی
دکتر مهدی نباتی – استاد برتر شیمی کنکور ایران
شیمی دوازدهم نباتی شیمی دوازدهم آقای نباتی شیمی دوازدهم دکتر نباتی شیمی دوازدهم مهدی نباتی شیمی دوازدهم آقای مهدی نباتی شیمی دوازدهم دکتر مهدی نباتی
دانش آموزان کنکوری عزیزم، فصل دوم شیمی دوازدهم (الکتروشیمی) یکی از آسان ترین فصل های درس شیمی کنکور است. با کمی دقت و یادگیری دقیق نیم واکنش ها برای هر نوع واکنش الکتروشیمیایی و یادگیری تمام نکات تحلیلی آن ها، به راحتی می توانید به هر ۴ سوال این فصل پاسخ دهید. لذا، یادگیری اصولی این فصل را اصلا پشت گوش نیندازید. چون سوالات این فصل نسبت به بقیه سوالات شیمی کنکور، آسان است.
به همین خاطر، امروز در این مقاله می خواهم با همدیگر نگاه دقیقی به عملکرد سلول دانز بیندازیم…
نکات تحلیلی سلول دانز
تصویر زیر، سلول دانز که در آن الکترولیز یا همان برقکافت سدیم کلرید مذاب اتفاق می افتد را نشان می دهد:
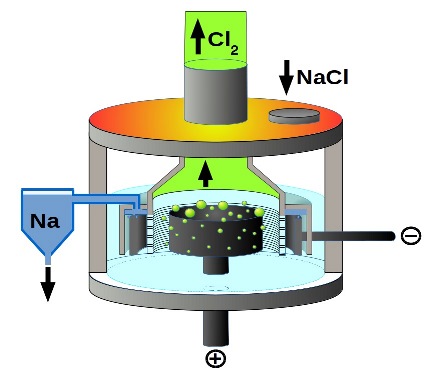
نکته اول: در سلول دانز، برقکافت (الکترولیز) سدیم کلرید مذاب اتفاق می افتد.
نکته دوم: حتما توجه شود که ورودی سلول دانز، سدیم کلرید مذاب (l) است نه سدیم کلرید محلول (aq).
نکته سوم: سدیم کلرید مذاب در حقیقت همان الکترولیت این سلول الکتروشیمیایی محسوب می شود.
نکته چهارم: چون دمای ذوب سدیم کلرید بالا (۸۰۱ درجه سانتی گراد) است، به همین خاطر برای کاهش دمای آن تا ۵۸۷ درجه سانتی گراد، مقداری کلسیم کلرید به آن اضافه می شود.
نکته پنجم: از برقکافت سدیم کلرید مذاب، برای تهیه فلز سدیم و گاز کلر استفاده می شود.
نکته ششم: فلز سدیم یک کاهنده قوی است و در طبیعت به صورت آزاد وجود ندارد. یون سدیم پایدارتر از عنصر فلز می باشد. به همین خاطر برای تهیه فلز سدیم، برقکافت سدیم کلرید مذاب (سلول دانز) یکی از بهترین روش ها است.
نکته هفتم: از روش برقکافت سدیم کلرید مذاب (روشی برای تهیه فلز سدیم) می توان برای تهیه بقیه فلزها همچون منیزیم نیز بهره برد.
نکته هشتم: در نیم واکنش آندی، آنیون کلرید اکسید شده و با افزایش یک عدد اکسایش از ۱- به صفر، به گاز کلر تبدیل می شود. پتانسیل استاندارد انجام این نیم واکنش برابر با ۱٫۳۹۶ ولت می باشد.
۲ Cl– → Cl2 + ۲ e
نکته نهم: در نیم واکنش کاتدی، کاتیون سدیم کاهش یافته و با کاهش یک عدد اکسایش از ۱+ به صفر، به فلز سدیم تبدیل می شود. پتانسیل استاندارد انجام این نیم واکنش برابر با ۲٫۷۱۳- ولت می باشد.
Na+ + e → Na
نکته دهم: واکنش کلی از جمع دو نیم واکنش آندی و کاتدی (بعد از همسان سازی ضزایب مولی الکترون ها) به صورت زیر است:
۲ NaCl → Cl2 + ۲ Na
نکته یازدهم: در این واکنش الکتروشیمیایی، ۲ الکترون به ازای هر واکنش کامل بین اکسنده و کاهنده مبادله می شود.
نکته دوازدهم: انرژی الکتروموتوری این واکنش الکتروشیمیایی به صورت زیر است:
emf = EK – EA = – 2.713 – 1.396 = – 4.109 V
نکته سیزدهم: با توجه به اینکه مقدار emf این واکنش الکتروشیمیایی کوچکتر از صفر است، پس این واکنش خودبخود اتفاق نمی افتد.
نکته چهاردهم: برای انجام این واکنش باید باتری بیرونی مورد استفاده قرار بگیرد و ولتاز بیشتر از ۴٫۱۰۹ ولت به سیستم داده شود.
نکته پانزدهم: بنا به نکته چهاردهم، بایستی قطب های باتری برعکس شود. در نتیجه، آند و کاتد (برخلاف سلول های گالوانی) به ترتیب قطب های مثبت (+) و منفی (-) می باشند.
استاد برتر شیمی کنکور ایران

استاد خوب شیمی کنکور تهران مشهد اصفهان کرج شیراز تبریز قم اهواز کرمانشاه ارومیه رشت زاهدان همدان کرمان یزد اردبیل بندرعباس اراک اسلامشهر زنجان قزوین سنندج خرم آباد گرگان ساری شهریار شهر قدس کاشان ملارد دزفول نیشابور بابل خمینی شهر سبزوار گلستان آمل پاکدشت نجف آباد بروجرد آبادان قرچک بجنورد ورامین بوشهر ساوه
تدریس خصوصی آنلاین و حضوری شیمی کنکور و المپیاد شیمی
قائم شهر بیرجند نسیم شهر سیرجان خوی ایلام بوکان شهرکرد سمنان فردیس مراغه شاهین شهر ملایر مهاباد سقز بندر ماهشهر رفسنجان گنبد کاووس شاهرود مرودشت کمال شهر
 Iranian Chemist شیمیدان ایرانی
Iranian Chemist شیمیدان ایرانی



